難治性・治療抵抗性B細胞性リンパ腫の克服
造血器悪性腫瘍において、非ホジキンリンパ腫、なかでも成熟B細胞性腫瘍は最も高頻度の疾患群です。近年、抗CD20抗体と化学療法剤を併用した免疫化学療法によって、B細胞性腫瘍の治療成績は著明に改善しましたが、いまだに一部の症例、あるいは病型は現存治療戦略では効果が不十分で予後不良な症例が残ります。
本プロジェクトでは、
- 「高悪性度B細胞性リンパ腫の分子病態の解明による新規診断法と分子標的治療の開発」
- 「高リスク濾胞性リンパ腫の臨床診断と分子細胞遺伝学的背景の解明」
- 「マントル細胞リンパ腫の分子病態解析に基づく新規分子標的治療戦略の開発」
を主たるテーマとしており、臨床的な予後不良症例を診断時に高感度・高精度に抽出しうる臨床的バイオマーカーを明らかにし、その応用による治療強度の層別化の具現化に挑戦する一方、難治病態獲得の原因となる分子生物学的な異常の同定を通じて、「簡便・迅速、しかし論理的」な診断システムと新規治療戦略の開発を目指した研究を進めています。
1.「高悪性度B細胞性リンパ腫の臨床診断と分子病態の解明、ならびに新規分子標的治療の開発研究」プロジェクト
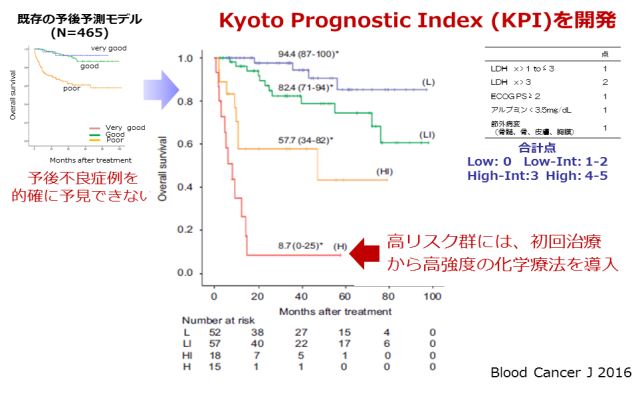
DLBCLに対する新予後予測スコアの開発
KOTOSGでの関連組織における、び漫性大細胞型B細胞リンパ腫(Diffuse large B cell lymphoma: DLBCL)症例の臨床的解析を実施し、LDH値, ECOG Performance status, アルブミン値、節外病変部位からなるKyoto Prognostic Index (KPI)を構築しました。KPIでは標準治療のみでは2年生存率が10~20%しか期待できない極めて予後不良な症例を診断時に高精度に抽出することが可能であり、また、KPIは従来、DLBCLの予後予測に用いられてきた国際予後分類などよりも統計学的に有意に予後予測能、リスク分解能が優ります(Kobayashi T, Blood Cancer J, 2016)。KPIの臨床的意義は、日本臨床腫瘍グループ(JCOG)リンパ腫グループにおけるDLBCLを対象とした臨床試験コホートでも再確認されており(Kobayashi T, Jpn J Clin Oncol 2022)、KPIによる高リスク症例には、治療開始当初から、より治療強度を高めた化学療法を計画することで、予後の改善が得られるかどうかは重要な臨床的課題です。実際、教室での後方視的検討では、強化免疫化学療法によって、予後を改善する可能性が示唆されています(藤野, 発表準備中)。
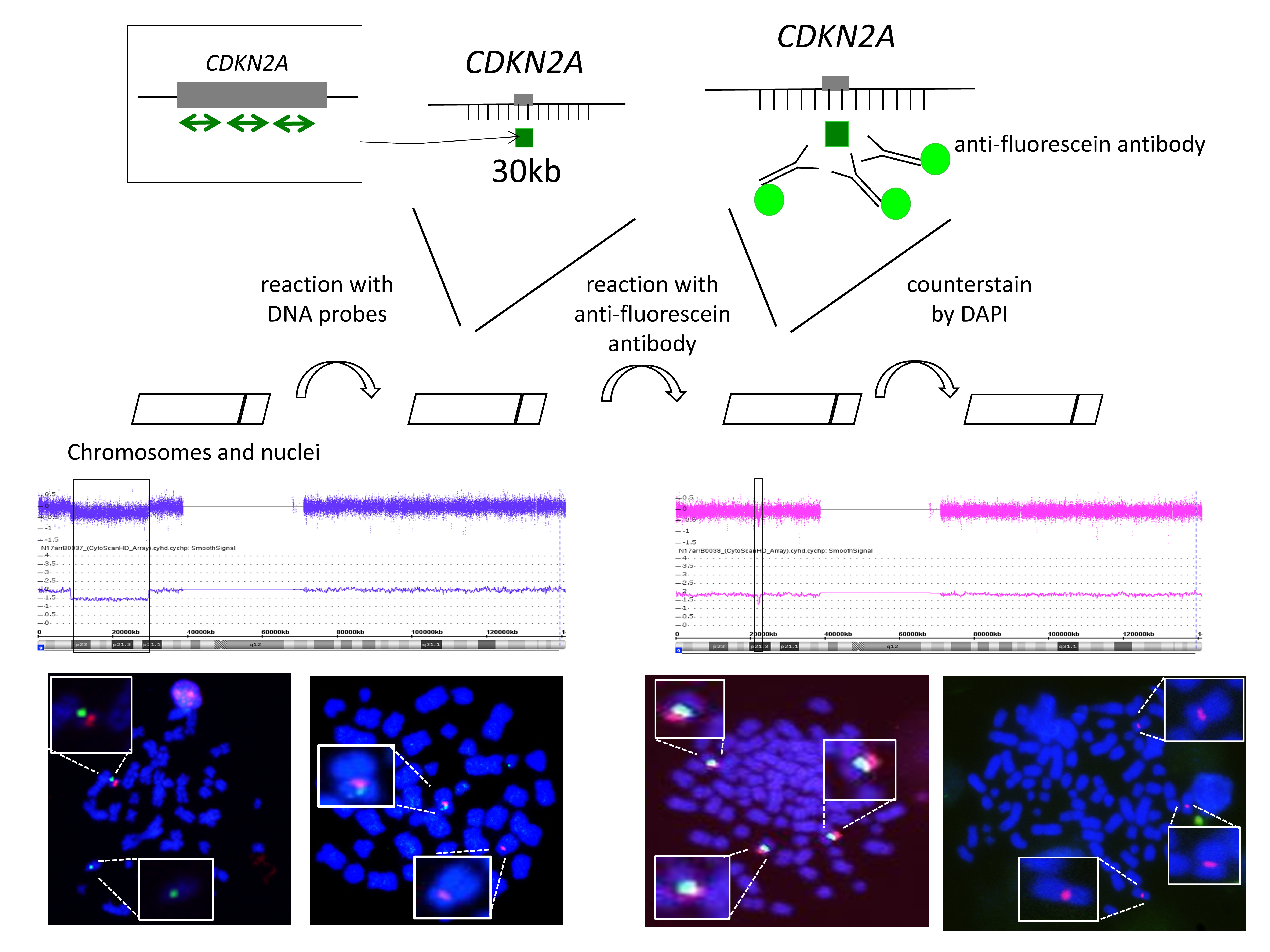
ウルトラ高リスクDLBCLの分子腫瘍学的異常の解明による分子標的探索と診断法の開発
KPI高リスクのようなウルトラ高リスク症例における生命予後の改善のためには、病態形成を司る細胞遺伝学的・分子生物学的異常の同定と、分子生物学的診断法・新規治療法の開発が喫緊の課題です。われわれは、こうした高リスク病態を形成する分子生物学的異常として、多くの症例が、がん遺伝子c-MycとBCL2などの抗アポトーシス分子などの異常を同時に有すること、これらの分子の発現亢進は染色体異常、遺伝子増幅、マイクロRNAや長鎖非コードRNAであるPvt-1など非コードRNAによるエピジェネティック異常など多岐にわたること(Sasaki N, Exp Hematol 2011)、それらの異常に加えて、癌抑制遺伝子であるCDKN2A/2Bの欠失が重複する場合に極めて予後不良となることを見出しました(Tsutsumi Y, Leuk Lymphoma 2013)。こうした分子異常を有する腫瘍細胞への治療薬開発研究を推進することを目的に、独自に高悪性度B細胞リンパ腫由来細胞株を複数樹立し、その詳細な検討を行った結果、古典的化学療法剤に対する感受性が乏しい一方で、BH3蛋白模倣薬によるBCL2阻害に対して高感受性であり、新規治療戦略として期待できることを見出し(Sasaki N, Exp Hamtol 2011)、現在、より強力なBH3模倣薬の開発、ならびにBCL2阻害剤と強力な併用効果を発揮しうるエピジェネティック標的戦略としてのBRD4阻害剤の応用(Takimoto-Shimomura T, Invest New Drug 2018)、通常の染色体分析では解析できない微小染色体欠損によるCDKN2A/2B欠失を簡便・迅速・安価に診断可能とする診断法として増幅FISH法(Amplified FISH: AM-FISH)の開発を進めています(Mizuno Y, Int J Hematol 2019)。
“Precision Medicineへの逆襲” PDPK1/RSK2シグナル標的化治療の開発
時代は個別症例におけるゲノム異常の同定に基づく個別化治療の推進の潮流のなかにあります。しかし、これにはいくつかの問題があります。
すなわち、
「単独の分子異常を標的とした治療戦略は、なんらかの代替経路の活性化による治療抵抗性獲得が多くの場合に誘導される」という基礎医学的観点、ならびに 「そもそも希少な疾患体系のなかで、さらに細分化された希少病態を対象とする場合、コスト、患者リクルートの両面から治療薬の臨床開発(治験)そのものが容易ならない」
という極めて現実的な問題に直面します。理想と現実には大きな隔たりがあるのです。
では、どうするのがよいか?
その一つの方法として、様々な分子腫瘍学的異常の関わらず、理論的な基盤のもと、様々な疾患亜病型に横断的に有効な治療戦略が開発できれば、先述の問題の幾何かを克服しうる可能性があると私たちは考えています。我々はこれまで多発性骨髄腫に対する分子標的探索研究プロジェクトにおいてPDPK1/RSK2シグナルの治療標的としての可能性を見出しましたが、さらにこれが広くB細胞性リンパ腫にも応用可能であることを見出しました。さらにDLBCLではRSK2の過剰活性化が予後不良と関連することを見出し、その治療標的分子としての妥当性が示されています(Onishi A. 執筆中、2023年第65回米国血液学会年次総会)。さらに、私たちは同様にPDPK1の標的分子であるAKT、S6KがRSK2の機能を補完的に強化していること、これらの同時阻害を可能とする小分子化合物が、疾患亜分類に関わらず、ほぼ普遍的にあらゆる病型のB細胞性リンパ腫(BCL)に対する抗腫瘍効果を有することを見出しました(Katsuragawa-Taminishi Y, Cancer Sci 2023)。これであれば、様々なBCLに難渋する多くの患者さんが対象になりますので、今後の臨床開発にも期待が持てるのではないでしょうか。決してたやすくはありませんが、産学連携での研究推進に挑戦したいと考えています。

PDPK1/RSK2シグナル標的化治療の開発
我々は多発性骨髄腫に対する分子標的探索研究プロジェクトにおいてPDPK1/RSK2シグナルの治療標的としての可能性を見出しましたが、これが広くB細胞性リンパ腫にも応用可能であることを見出し、現在、鋭意、研究継続中です(大西、桂川ら)。
2.「高リスク濾胞性リンパ腫の臨床診断と分子細胞遺伝学的背景の解明」プロジェクト
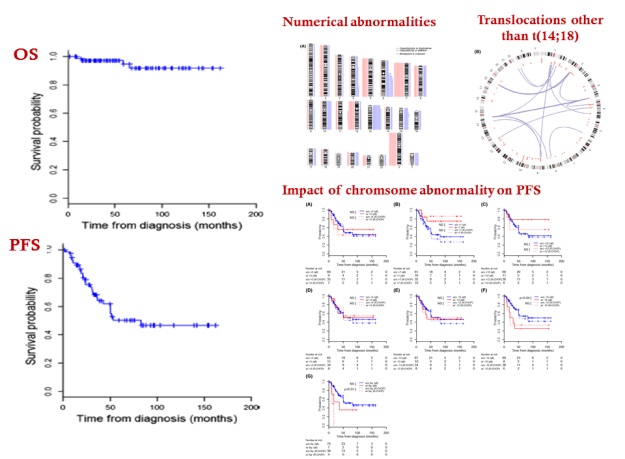
濾胞性リンパ腫における付加的染色体異常6q欠失の予後不良への影響の解明と臨床応用
濾胞性リンパ腫(follicular lymphoma:FL)は特異的染色体転座であるt(14;18)(q32;q21)、抗アポトーシス分子BCL2の過剰発現を特徴とするB細胞リンパ腫であり、非ホジキンリンパ腫の20%程度を占める低悪性度リンパ腫の代表的病型です。経過は一般に緩徐であり、近年の我々の施設での10年全生存期間(overall survival: OS)は約90%と極めて良好である一方、5年無増悪生存割合(progression-free survival: PFS)は約50%程度と不良であり、このことからもFLは再発・再燃を繰り返す化学療法抵抗性の疾患単位であり、いかにPFSの不良な症例の予後を改善するかが重要な課題です。そこで我々は、既存の予後予測指数であるFLIPIがOSの指標であるのに対し、PFSが短期に留まる症例を抽出しうる臨床的な予後予測モデルの構築、ならびに、PFS短縮症例の細胞遺伝学的・分子生物学的特徴の解明に挑戦し、KOTOSGでの多施設共同研究によって、顕微鏡下の観察で末梢血に腫瘍細胞の浸潤を認める症例、骨に病変を認める症例のPFSが有意に短いこと、PFS不良と付加的染色体異常としての6q染色体の欠失の相関(Tsukamoto T, Int J Hematol 2017)が判明しました。6q欠失によりA20遺伝子の欠失が生じ、NFkB経路の活性化が誘導され、予後不良病態獲得に寄与することが想定され、AM-FISH法による迅速診断法も開発しています。
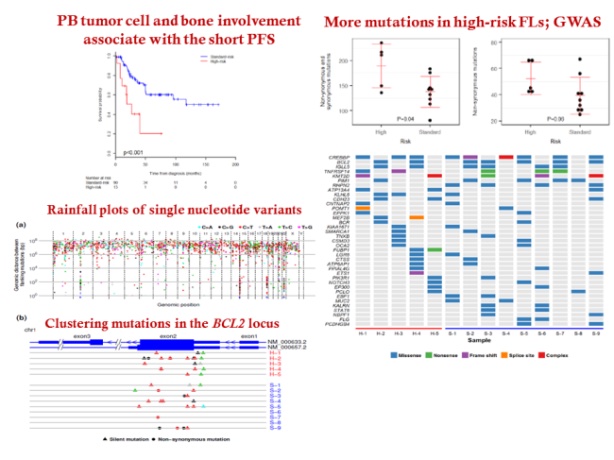
濾胞性リンパ腫の予後は、AID signatureを示す遺伝子異常の多寡により規定されることを発見
さらに、本学ゲノム医科学教室との共同研究にもと、次世代シーケンサーを用いた解析により、PFS短縮症例では、より多くの非特異遺伝子異常を有すること、それらはmutation signatureとしてAID signatureであるものを多く含むことが判明しました。すなわち、病勢進行や治療抵抗にと、遺伝子不安定性に伴う非特異的遺伝子異常の蓄積の相関が明確になったわけです(Tsukamoto T, Sci Rep 2017)。現在、本研究で明らかになった新規遺伝子異常の機能的解析(長田ら)、ならびに遺伝子不安定性の獲得を促進する分子メカニズムの解明と治療的制御法の開発に向けた研究、分子診断法の開発研究、ならびに遺伝子不安定性を指標にした細胞療法・免疫療法を含めた病型毎の治療標的探索に関する研究を進めています。
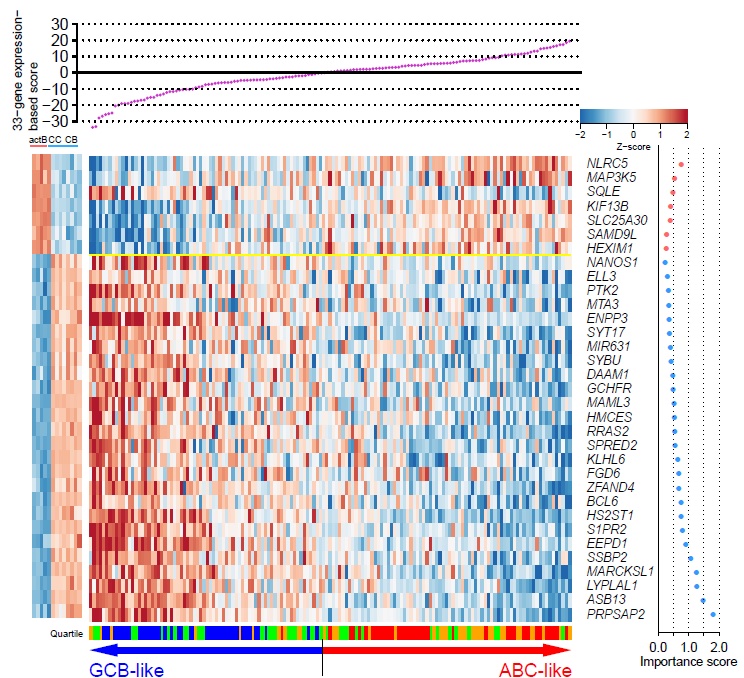
GCB-like, ABC-likeで識別する遺伝子発現パターンに基づく濾胞性リンパ腫の新規予後分類の確立
FLは、典型的にはリンパ組織内の胚中心B細胞が腫瘍細胞の発生起源とされています。しかし、同じ疾患群であっても予後が明らかに異なる症例が存在するため、その異なる臨床像の背景にある分子学的特徴を解明することを目的とし、塚本はweb で公開されているFLの遺伝子発現のマイクロアレイの大規模データと、それに付随する基礎・臨床データを用いた統合解析を行いました。その結果、探索コホートデータの遺伝子発現プロファイル解析において、正常胚中心B細胞に特徴的な遺伝子を一様に高発現する濾胞性リンパ腫の一群がある一方で、一様に低発現な群が存在することが明らかになりました。そこで、この両者を明確に分類するために有用な33個の遺伝子を機械学習により抽出し、33個の遺伝子発現量に基づいたスコアリング計算式を作成して、そのスコアで濾胞性リンパ腫を分類することに挑戦しました。その結果、仮説通り、胚中心B細胞に似た発現パターンをとるFL (GCB-like FLと命名)と活性化B細胞に似た発現パターンをとるFL (ABC-like FLと命名)に分類可能であることが明らかになりました。この分子生物学的な新規分類法を用いると、複数の検証コホートデータでも同様の発現パターンを示すFLに分類可能であっただけでなく、GCB-like FLではMEF2BおよびEZH2遺伝子変異陽性の割合が高く、一方でABC-like FLではt(14;18)陰性、6番染色体長腕の6q13領域の欠失の割合が有意に高いという特徴が明らかになりました。なお、最も頻度の高い悪性リンパ腫であるDLBCLにおいては腫瘍細胞の発生起源からGCB-DLBCLとABC-DLBCLに分類可能であることが既に知られていますが、GCB-like FLとGCB-DLBCL、ABC-like FLとABC-DLCBLが、IRF4、Blimp-1(PRDM1)、BCL6といったB細胞分化制御分子と関連する遺伝子発現プロファイルにおいて類似した特徴を有することも明らかになりました。さらに重要なこととして、複数のコホートデータにおいてABC-like FLはGCB-like FLに比して有意に予後不良であり、多変量解析から既存の予後因子とも独立した予後指標であることが示されました(Tsukamoto T, Blood Adv 2022)。今後、この分子分類法の臨床実装化に向けた簡便診断法の確立、大型臨床試験での検証と臨床導入を進めていく予定です。
3.「マントル細胞リンパ腫に対する新規分子標的治療戦略の開発」プロジェクト
近年、化学療法に関するエビデンスの蓄積、各種の分子標的治療薬の開発、大量化学療法・造血幹細胞移植の効果的な併用などによって、マントル細胞リンパ腫(Mantle cell lymphoma: MCL)の治療予後は改善途上にあります。しかし、いまだにMCLはB細胞性リンパ腫のなかで、最も治療に難渋するサブタイプのひとつとして残されており、さらなる治療開発が最も望まれるサブタイプともいえます。そこで、我々は、MCLに対する新規治療開発を研究テーマの一つと掲げ、多角的に疾患克服に向けた研究を展開しています。
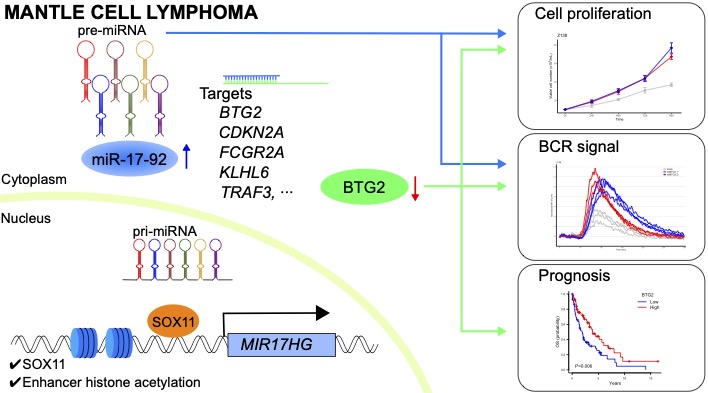
MCL特異的なmiR-17-92クラスターにより制御される新たなB細胞受容体シグナル活性化機序の発見
MCLではB細胞受容体(BCR)シグナルが恒常的に活性化しており、そのシグナル構成分子であるBTKに対する阻害薬が抗腫瘍効果を発揮します。しかしBTK阻害剤抵抗性MCLの予後は不良であり治療抵抗性克服が喫緊の課題であるものの、MCLにおけるBCR受容体シグナル活性化機序自体が十分に解明されていません。MCLにおいて恒常的に発現亢進しているマイクロRNAであるmiR-17-92クラスターが、MCLの正常発生母地であるナイーブB細胞に比べ、腫瘍特異的にエピジェネティックレベルで発現制御されていることを見出し、miR-17-92クラスターがBCRシグナル活性化に関わることを明らかにしました。また、miR-17-92が制御する分子を次世代シーケンサーを用いて網羅的に解析したところ、新規標的分子としてがん抑制遺伝子であるBTG2を同定しました。重要なこととして、BTG2がBCRシグナルを制御することをin vitroならびに臨床検体による検討から明らかにしました。現在、BTG2がBCRシグナル調節に関わる分子機構の解明を目標とした研究を展開していますが、BCR活性化機序に関わる新知見の集積により、新規治療戦略の開発や治療抵抗性克服につなげる基盤的な研究となることを目指しています(塚本・金山ら)。
PDPK1/RSK2標的化分子標的治療の基盤構築
研究室では,MCLにおいてセリンスレオニン・キナーゼであるPDPK1の治療標的としての可能性を見出したほか(Maegawa S, Exp Hematol 2018)、さらにPDPK1による直接的な活性制御のもと、細胞シグナル伝達のハブとして多くのエフェクター分子を制御するRSK2の治療標的としての可能性を見出しました。RSK2はMCLにおいて、多くのB細胞受容体シグナル構成分子、B細胞の生存・分化を司る分子群、ならびにMycやアポトーシス制御性BCL2ファミリー分子など、いずれもその制御異常がB細胞性腫瘍の発症を促進する分子の発症を少なくとも転写レベルで重複的に制御していることを明らかにしています(Matsumura-Kimoto Y, Cancer Med 2020)。
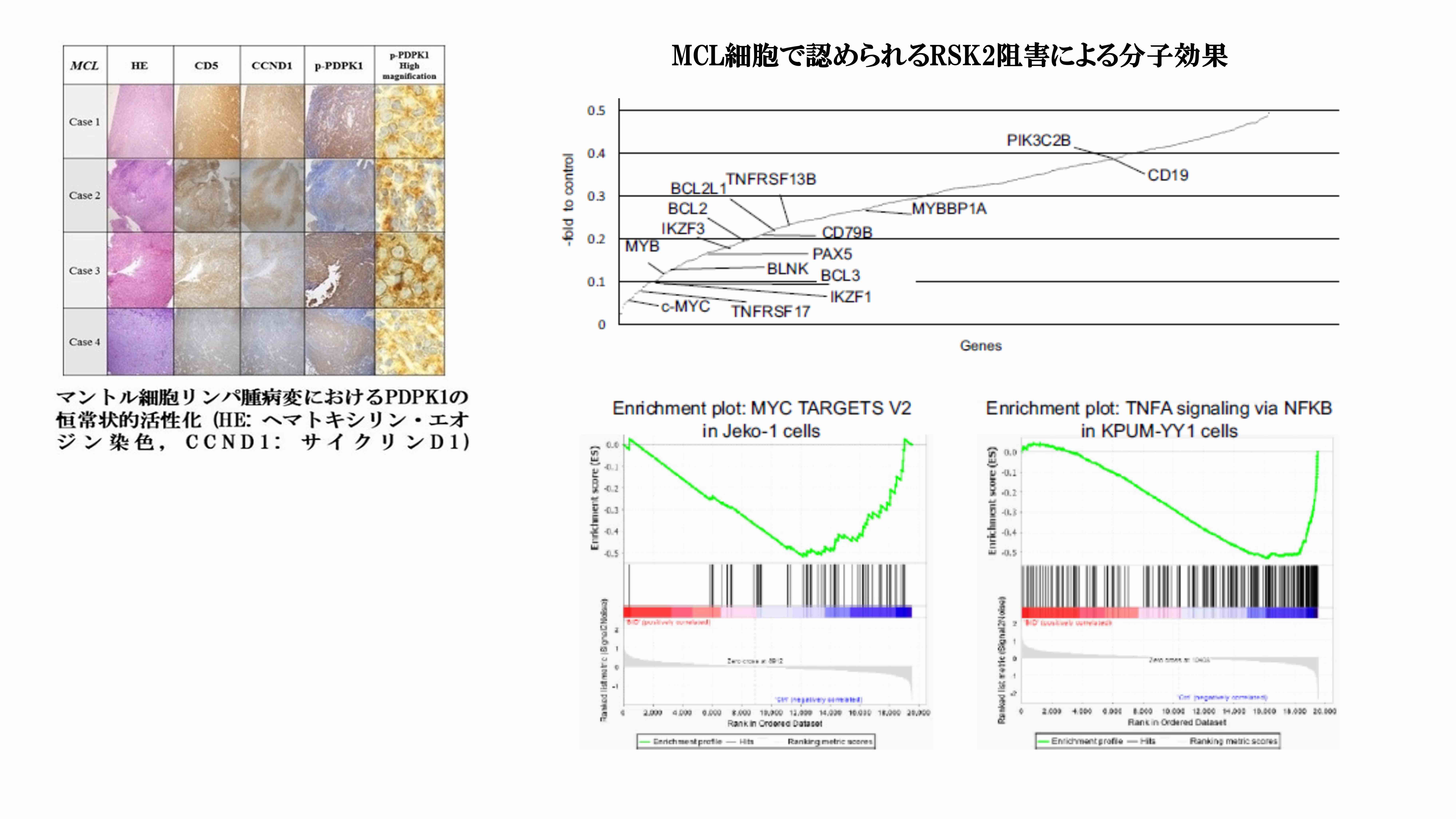
BRD4被制御分子の網羅的スクリーニングによるB細胞受容体シグナル分子・B細胞分化関連分子の重要性の同定
MCLの疾患形成に重要な役割を担う分子の抽出を目的に、ブロモドメインタンパク質であるBRD4被制御分子シグナル経路の網羅的解析を行いました。その結果、MCLに対する治療標的候補分子の探索的研究でも、B細胞受容体シグナル構成分子、B細胞分化関連分子、ならびにアポトーシス制御性BCL2ファミリー分子の重複的な制御が病態制御に重要であることを見出しました(Tsukamoto T, Cancer Genomics Proteomics 2020)。これらの成果から、研究室ではMCLの疾患制御に向け、MCL特異的なBCRシグナルの活性化機序の解明、その制御戦略の開発に向けた研究を展開中です(塚本、金山、長田ら)。
MCLに対する標準的治療戦略に対する抵抗性獲得機序の解明と克服戦略の開発
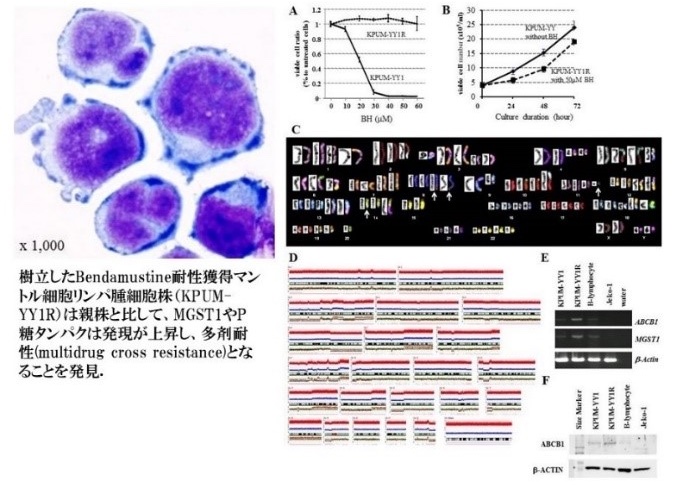
MCLの治療戦略として化学療法薬であるBendamustine、BTK阻害剤であるIbrutinibが加わったことにより、その予後は大きく改善しました。一方、これらに対する抵抗性の獲得は重大な臨床アウトカムへの影響を及ぼします。その他、我々は治療抵抗性MCL症例から独自に細胞株を樹立するとともに、さらにMCLに対する主戦力のひとつであるBendamustineに対する抵抗性を獲得した亜株も樹立し、その分子生物学的異常の異同を詳細に検討することで、Bendamustineに対する抵抗性獲得機序とその克服戦略の開発のための研究を行い、新規診断法や治療戦略の工夫に関する知見を臨床現場に還元する試みを行っています(Takimoto-Shimomura T, Cancer Genomics Proteomics, 2018)。

 京都府立医科大学
京都府立医科大学